立体構造に基づいた糖質関連酵素の触媒反応機構の解明
α-amylaseは,デンプンやグリコーゲンのα-1,4グリコシド結合を加水分解するendo型酵素であり,古くからデンプン加工業をはじめ,醸造業,製紙業,製薬業など多くの産業において利用されている。これらの工業において特に重要となるのが,α-amylaseの熱安定性や基質特異性,生成物の特性の改良であり,そのためには酵素の活性部位の構造と機能の相関関係の解明が必要となる。そこで当研究室では,α-amylaseの一つであるTAKA amylase A (TAA) の部位特異的変異体を大量発現し,NMR測定により部位特異的変異による構造変化の解析を行っている。
また,多くのamylaseがα-amylaseと一次構造や機能の上で類似性を持つのに対し,β-amylaseはα-amylaseとそのような類似性がなく,amylaseの中で独自の位置を占めている。また,微生物起源のβ-amylaseは,植物起源の酵素より安定でデンプン吸着能を有する。このようなβ-amylaseの独自性と起源の違いに基づく機能の相違などを明らかにするために,植物と微生物起源のβ-amylaseについても,NMR測定による部位特異的変異による構造変化の解析,反応速度論,遺伝子組み換え,その他種々の化学的,物理学的方法により,構造と機能の関係を解析している。
さらに,amylaseを含む多くの糖質関連酵素には,触媒ドメインとは別にstarch binding domain (SBD) をもつものがあり,SBDをもたないamylaseよりもデンプン粒分解活性が高いことが知られている。SBDをデンプン粒分解能を向上させるキーファクターと考え,SBDを単離し,マルトオリゴ糖に対する結合親和性を等温滴定熱量測定法などの手法を用いて測定している。さらにNMRを用いた溶液中での三次元構造解析を行うことで,立体構造やデンプン粒結合部位に関する知見を得ている。
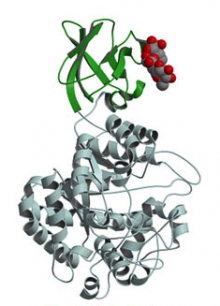
Figure. β-Amylase from Bacillus cereus var. micodes