記事
2023年8月1日
造影MRIからメチオニンPETを合成するAIの作成と検証
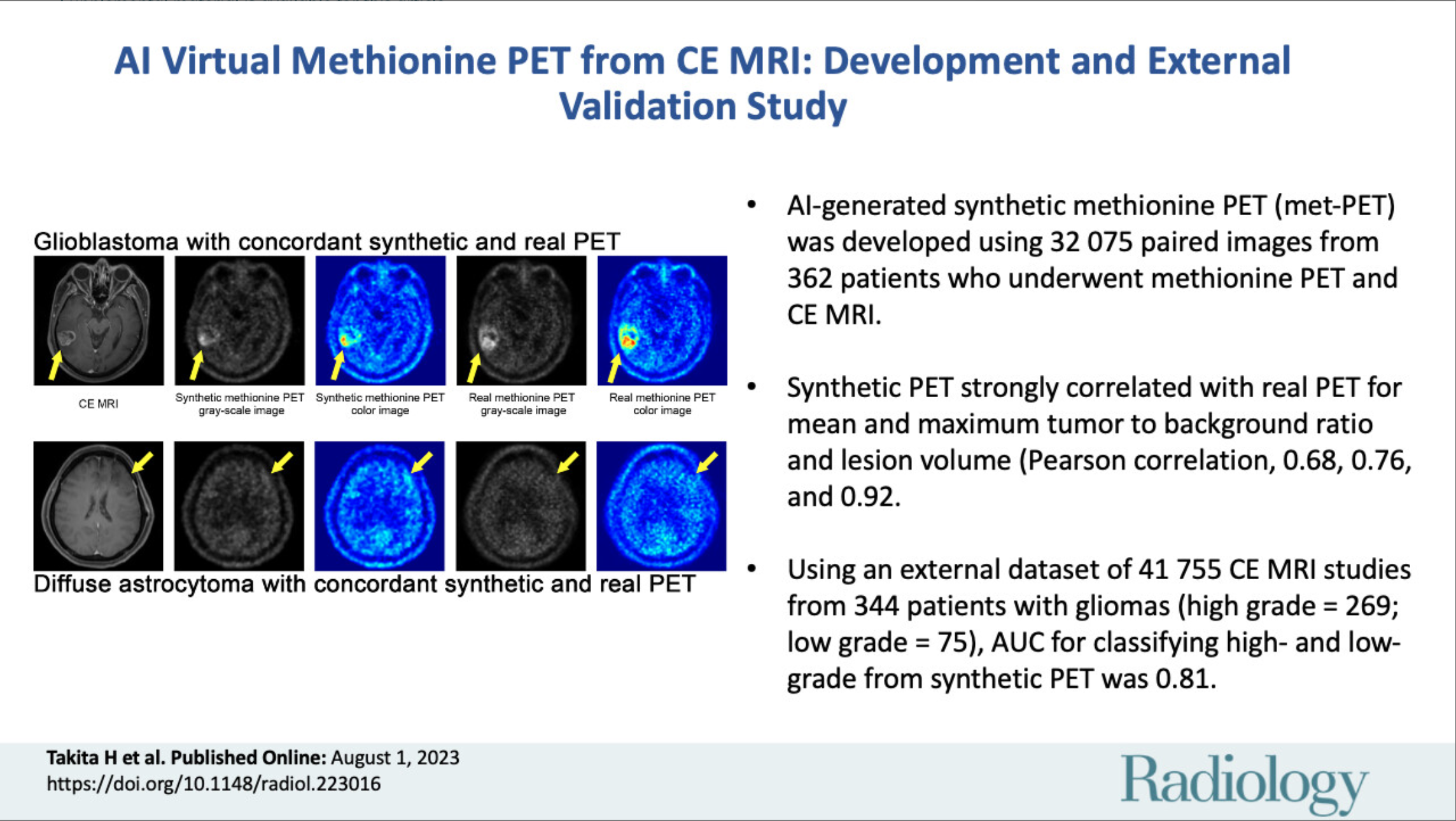
造影MRIをもとに人工知能でメチオニンPET画像を合成し、悪性度や予後を評価する手法の有用性を検証しました。
論文
AI-based Virtual Synthesis of Methionine PET from Contrast-enhanced MRI: Development and External Validation Study
Radiology
https://doi.org/10.1148/radiol.223016
著者談
私たちは、脳腫瘍の診断や治療方針決定で特に有用とされるメチオニンPETを、より多くの施設や患者さんに提供できないかを考え続けてきました。ところが、メチオニンPETは放射性同位元素を用いる関係で導入が難しく、核医学の施設や装置が限られてしまいます。そこで、造影MRIを基盤にAIによる画像変換を行い、実際のPETに近い情報を得られないかと着目しました。本研究では国際的なオープンデータや多施設のデータセットを組み合わせ、悪性度予測や予後予測といった定量的な検証を丁寧に行いました。また、核医学分野へのAI応用を進めるうえで数多くの実験を一つにまとめましたので、ぜひ論文の補足資料も合わせてご覧いただければと思います。なお、筆頭著者の田北大昂先生が神経放射線学会で加藤賞を受賞したことは、私たちにとって大きな励みとなっています。
論文概要
本研究では、造影MRI画像を入力として合成メチオニンPET画像を生成し、その精度と臨床的有用性を評価しました。まずは当大学病院から得られた362名分のデータを使って学習・検証を行い、続いて海外の344名の症例を外部テストとして用いました。その結果、合成画像と実際のメチオニンPETとの間で最大腫瘍対背景比(TBRmax)の相関係数が0.68、病変ボリュームでは0.92を示し、統計的にも高い一致を確認しました。さらに、外部テストデータにおいて合成PET画像のTBRmaxを用いた高悪性度と低悪性度の鑑別ではAUCが0.81を示し、2年生存率も高値群71%、高リスク群27%と有意差が認められています。
論文詳細
私たちは、メチオニンPETの高い診断力を支える“腫瘍の代謝活性”と、造影MRIで捉えられる“腫瘍血管透過性”などの特徴が、一定の相関関係を持つ可能性に着目しました。そこに画像変換用の生成対向ネットワーク(pix2pixモデル)を組み込み、三次元的な脳腫瘍の形態を捉える工夫や、病変領域だけでなく脳全体を含む形でのデータサンプリングを実施しました。内部テストではTBRmaxやTBRmean(相関係数0.76)だけでなく、病変体積に関しても実測PETと近い結果を得ました。さらに、外部のデータベースを用いた検証でも、合成したPET画像を使って高悪性度か低悪性度かを判別した際にAUC 0.81と安定した数値を示し、治療後の2年生存率にも明確な違いが見られました。過剰に期待を煽ることは避けなければなりませんが、合成メチオニンPETが実測と概ね同程度の指標を提供しうる可能性が示されたことは、大きな意義があると考えています。ただし臨床導入にはさらなる大規模検証や前向き試験が必要であり、私たちは今後も補足実験や長期追跡を継続していきたいと思います。