実験動物学
基本情報
分子生体医学講座 実験動物学
代表者 大谷 直子教授(兼任)
実験動物学は、昭和50年(1975年) に動物実験施設が作られたときに併設され、教員が配置されました。医学研究のためには、動物実験は必要不可欠な手段です。実験動物を用いた医学研究の進歩は目覚ましく、基礎医学研究の分野だけでなく、臨床医学の研究にも重要です。一方、動物愛護の精神から、動物実験において3R の原則(Replacement:代替法の利用、Reduction:使用動物数の削減、Refinement:苦痛の軽減)を尊重しなければなりません。また、外部機関による検証も行われます。動物実験施設の利用者に対して、実験動物の健康維持(SPF)、実験動物の倫理的取扱いを教育することが重要です。それにより、研究者がより良い状態で、優れた研究ができるようにするのが施設の務めと考えています。
さらに、平成29年(2017年)より医学研究科内限定で、CRISPR-Cas9法による遺伝子改変動物(マウス)の作製、精子凍結保存、受精卵凍結保存、凍結精子・受精卵からの個体化などの研究支援を行っています。

- 場所
- 動物実験施設本館 2階
- 連絡先
- TEL:06-6645-2672
教育方針
学部教育
- 学部生(2回生)の「医学研究推進コース2(分子系実習・遺伝子コース)」を担当しています。
- 学部生(3回生)の医学研究推進コース3において、動物実験を行う際には動物実験に関する教育を担当しています。
- 大学院生、研修生、留学生が動物実験を行う際も、動物愛護の精神に基づく、取扱い方法、実験計画の立て方などを指導します。
臨床教育(研修医の育成)
該当はありません。
研究指導
実験動物を用いた研究を行う場合には、最初に、動物愛護の精神、動物の扱い方、実験方法の選択、SPFなどクリーンな環境の維持に関する講習を行い、適正な実験ができるよう教育・指導を行います。また、遺伝子改変マウスの扱い方、繁殖方法、系統維持法、SPF化などについて指導します。
研究について
概要
現在、CRISPR-Cas9法を用いて、各種、遺伝子改変マウスの作製を行っています。非相同末端結合によるDNA切断後の塩基の欠損によるノックアウトマウスの作製、アミノ酸を置換させるような鋳型DNAを導入することにより、相同組換え修復を起こして、アミノ酸を置換させるノックインマウスの作製を行っています。また、精子の凍結保存、受精卵の凍結保存、体外受精による繁殖しにくいマウスの人工的な繁殖などの基盤的研究支援を行っています。
さらに、遺伝子改変の原理は、本来、放射線によるDNAの切断の修復に役立っていることから、当研究室では、このようなDNA損傷修復遺伝子にも注目し、宇宙放射線によるDNA損傷や染色体異常の解析から生物への影響を解析する研究を行っています。
教室を代表する業績
- Yoshida K, Hada M, Hayashi M, Kizu A, Kitada K, Eguchi-Kasai K, Kokubo T,Teramura T, Hashizume Suzuki H, Watanabe H, Kondoh G, Nagamatsu A, Saganti P, Muratani M, Cucinotta FA and Morita T. Transcriptome Analysis by RNA Sequencing of Mouse Embryonic Stem Cells Stocked on International Space Station for 1584 Days in Frozen State after Culture on the Ground. International Journal of Molecular Sciences 2024: Mar: 25 ( 6 ) 3283
- Yoshida K, Hada M, Kizu A, Kitada K, Eguchi-Kasai K, Kokubo T, Teramura T, Yano S, Suzuki HH, Watanabe H, Kondoh G, Nagamatsu A, Saganti P, Cucinotta FA, Morita T. Comparison of biological measurement and physical estimates of space radiation in the International Space Station.Heliyon. 2022 Aug 18;8(8):e10266. doi: 10.1016/j
- Takada N, Takasugi M, Nonaka Y, Kamiya T, Takemura K, Satoh J, Ito S, Fujimoto K, Uematsu S, Yoshida K, Morita T, Nakamura H, Uezumi A, Ohtani N. Galectin-3 promotes the adipogenic differentiation of PDGFRα+ cells and ectopic fat formation in regenerating muscle. Development. 2022: Feb: 1;149(3):dev199443. doi: 10.1242/dev.
- Uemura R, Tachibana D, Shiota M, Yoshida K, Kitada K, Hamuro A, Misugi T, Koyama M. Upregulation of PTK7 and β-catenin after vaginal mechanical dilatation: an examination of fibulin-5 knockout mice. Int Urogynecol J. 2021: Nov;32(11):2993-2999. doi: 10.1007/s00192-021-04693-2.
- Hirotsune S, Kiyonari H, Jin M, Kumamoto K, Yoshida K, Shinohara M, Watanabe H, Wynshaw-Boris A, Matsuzaki F. Enhanced homologous recombination by the modulation of targeting vector ends. Scientific Reports 2020: Feb: 10 ( 1 )
- Hayashi M, Yoshida K, Kitada K, Kizu A, Tachibana D, Fukui M, Morita T, Koyama M. Low-dose irradiation of mouse embryos increases Smad-p21 pathway activity and preserves pluripotency. Journal of Assisted Reproduction and Genetics 2018: Mar 16: pp1-9
- Umeda T, Kimura T, Yoshida K, Takao K, Fujita Y, Matsuyama S, Sakai A, Yamashita M, Yamashita Y, Ohnishi K, Suzuki M, Takuma H, Miyakawa T, Takashima A, Morita T, Mori H, Tomiyama T. Mutation-induced loss of APP function causes GABAergic depletion in recessive familial Alzheimer's disease: analysis of Osaka mutation-knockin mice. Acta Neuropathol Commun. 2017: Jul: 31;5(1):59. doi: 10.1186/s40478-017-0461-5.
- Kitada K, Kizu A, Teramura T, Takehara T, Hayashi M, Tachibana D, Wanibuchi H, Fukushima S, Koyama M, Yoshida K, Morita T. Gene-modified embryonic stem cell test to characterize chemical risks. Environ Sci Pollut Res. 2015: Nov: 22 (22): 12-13
- Yoshida K, Hada M, Teramura T, Cucinotta FA, Morita T. Estimation of effects of space radiation using frozen mouse ES cells in ISS. J. Radiation Res. 2014: 55: S1:12-13
- Thuy le TT, Morita T, Yoshida K, Wakasa K, Iizuka M, Ogawa T, Mori M, Sekiya Y, Momen S, Motoyama H, Ikeda K, Yoshizato K, Kawada N. Promotion of liver and lung tumorigenesis in DEN-treated cytoglobin-deficient mice. Am J Pathol. 2011 Aug;179(2):1050-60. doi: 10.1016/j.ajpath.2011.05.006.
- Nagata K, Kiryu-Seo S, Maeda M, Yoshida K, Morita T, Kiyama H. Damage-Induced Neuronal Endopeptidase Is Critical for Presynaptic Formation of Neuromuscular Junctions. J Neurosci. 2010 May 19;30(20):6954-62. doi: 10.1523/JNEUROSCI.4521-09.2010.
- Sun J, Yomogida K, Sakao S, Yamamoto H, Yoshida K, Watanabe K, Morita T, Araki K, Yamamura K, Tateishi S. Rad18 is required for long-term maintenance of spermatogenesis in mouse testes. Mech Dev. 2009 Mar-Apr;126(3-4):173-83. doi: 10.1016/j.mod.2008.11.004.
- Lee J, Kitajima T, Tanno Y, Yoshida K, Morita T, Miyano T, Miyake M, Watanabe Y. Unified mode of centromeric protein by shugoshin in mammalian oocyte and somatic cells. Nature Cell Biology 2008: 10: 42-52
- Nakada K, Sato A, Yoshida K, Morita T, Tanaka H, Inoue S, Yonekawa H, Hayashi J. Mitochondria-related male infertility.Proc Natl Acad Sci U S A. 2006 Oct 10;103(41):15148-53. doi: 10.1073/pnas.0604641103.
- Hayashi K, Yoshida K, Matsui Y. A histone H3 methyltransferase controls epigenetic events required for meiotic prophase. Nature 2005: 438: 374-378
- Shoji M, Chuma S, Yoshida K, Morita T, Nakatsuji N. RNA interference during spermatogenesis in mice. Dev Biol. 2005 Jun 15;282(2):524-34. doi: 10.1016/j.ydbio.2005.03.030.
- Habu T, Wakabayashi N, Yoshida K, Yomogida K, Nishimune Y, Morita T. p53 Protein interacts specifically with the meiosis-specific mammalian RecA-like protein DMC1 in meiosis. Carcinogenesis. 2004 Jun;25(6):889-93. doi: 10.1093/carcin/bgh099.
- Yoshida K, Morita T. Control of Radiosensitivity of F9 mouse teratocarcinoma cells by regulation of histone H2AX gene expression using a tetracycline turn-off system. Cancer Res. 2004 Jun 15;64(12):4131-6. doi: 10.1158/0008-5472.CAN-03-2566.
- Yoshida K, Yoshida SH, Shimoda C, Morita T. Expression and radiation-induced phosphorylation of histone H2AX in mammalian cells. J Radiat Res. 2003 Mar;44(1):47-51. doi: 10.1269/jrr.44.47.
- Kondoh G, Yamamoto Y, Yoshida K, Suzuki Y, Osuka S, Nakano Y, Morita T, Takeda J. Easy assessment of ES cell clone potency for chimeric development and germ-line competency by an optimized aggregation method.J Biochem Biophys Methods. 1999 May 13;39(3):137-42. doi: 10.1016/s0165-022x(99)00008-1.
- Yoshida K, Kondoh G, Matsuda Y, Habu T, Nishimune T, Morita T. The Mouse RecA-like Gene, Dmc1 is required for homologous chromosome pairing in meiotic. Mol. Cell 1998: 1: 707-718. doi: 10.1016/s1097-2765(00)80070-2.
- Yamamoto A, Taki T, Yagi H, Habu T, Yoshida K, Yoshimura Y, Yamamoto K, Matsushiro A, Nishimune Y, Morita T. Cell cycle-dependent expression of the mouse Rad51 gene in proliferating cells. Mol Gen Genet. 1996 Apr 24;251(1):1-12. doi: 10.1007/BF02174338.
主な研究内容
現在の主な研究テーマ
CRISPR-cas9法(ゲノム編集)による遺伝子改変マウスの作製
CRISPR-Cas9法による遺伝子改変動物の作製支援 (研究科内限定)
改変したい遺伝子の特定部位に相同なRNAを合成し、Cas9タンパクとともに受精卵に導入することにより、DNA二重鎖切断を起こします。切断されたDANが非相同末端結合により、欠失が起こります。切断される位置に改変した鋳型DNAを導入すると相同組換えにより変異が導入されます。この原理に基づいて、研究に必要な遺伝子改変マウス、疾患モデル動物を作製しています。
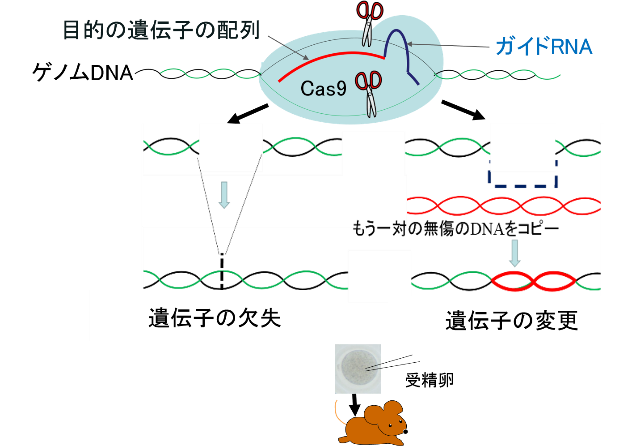
精子、受精卵の凍結保存と個体化
精子、受精卵の凍結保存と個体化の支援 (研究科内限定)
貴重な遺伝子改変マウス等の精子、受精卵を凍結保存しています。また、凍結保存された精子や受精卵の個体化を行っています。
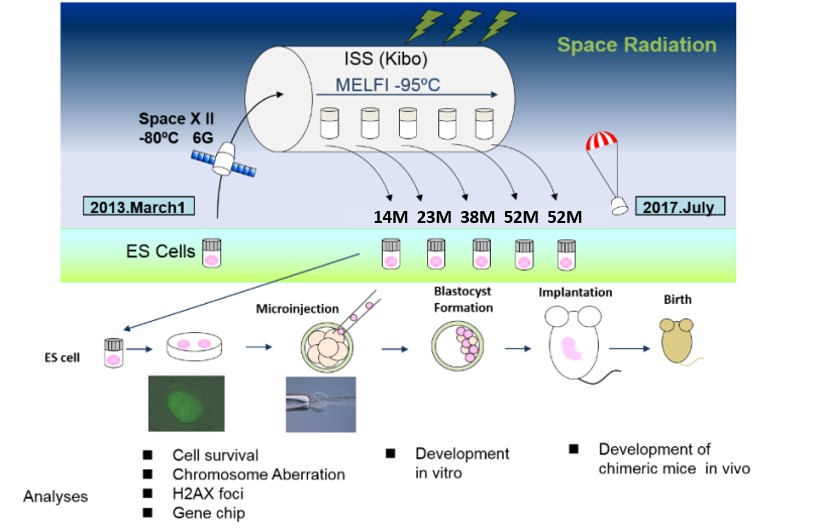
宇宙環境におけるマウスES細胞に及ぼす宇宙放射線の影響に関する研究
国際宇宙ステーションにおける長期有人宇宙滞在や、月面基地建設、有人火星探査等、人間が宇宙に長期滞在することが現実に近づいています。一方、宇宙空間は重粒子線等種々の宇宙放射線が錯綜し、これらに対するリスク評価や対策が急がれています。宇宙環境におけるマウスES細胞に及ぼす宇宙放射線の影響を解析するために、2013年3月1日に、マウスES細胞を国際宇宙ステーションに打ち上げました。冷凍庫(MELFI)内で長期保管(14, 23, 38, 52か月)し、宇宙放射線に被曝したES細胞を回収しました。現在、それらのES細胞について、染色体異常を解析し宇宙放射線の影響を解析しています。
HIMACを利用したマウスES細胞に及ぼす重粒子線の影響に関する研究
宇宙放射線には、重粒子線などによる影響が強いと考えられています。宇宙実験に対する地上(対照)実験として、量子科学技術研究開発機構 重粒子加速器『HIMAC』を用いて、ES細胞へ重粒子線(Fe, C, Ne, Si等)を照射し、種々の重粒子線の影響を解析しています。
スタッフ
| 教授(兼任) | 大谷 直子 |
|---|---|
| 准教授 | 吉田 佳世 |