研究内容
研究の目的
これまでの主な研究
① ロドプシン類の多様性と分子機能・特性との連関
1 新規ロドプシン類の発見
2 多様なロドプシン類の発現系の確立
3 多様なロドプシンの比較解析:対イオンの変位とロドプシン類の分子進化
4 Bistable pigmentの解析
研究の目的
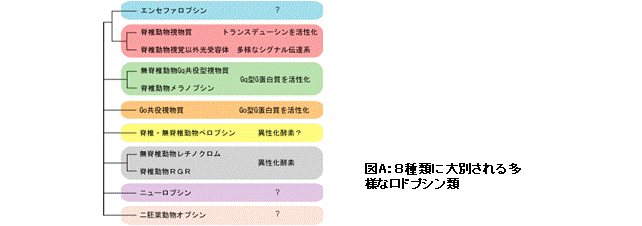
多くの動物は、光受容タンパク質である視物質ロドプシンやその類似タンパク質(以後、ロドプシン類と略)により光を受容し、それを視覚情報として利用するのみならず、たとえば生体リズムの調節など視覚以外の情報としても利用している。これまでに、1000種程度のロドプシン類が多彩な動物種から同定され、少なくとも8種類のグループに分類できることが分かってきた(図A)。
ロドプシン類は、“光受容”という細胞機能や生体機能の入口に位置し、光受容に特化したタンパク質であるので、それぞれのロドプシン類の分子性状・性質の多様性は、生体や細胞がもつ光受容機能と密接に関連していると考えられる。言い換えれば、多様なロドプシン類を使い分けられたり、または協調的に用いられたりすることにより、動物の持つ光受容が成り立っていると言える。
たとえば、ヒトは9つのロドプシン類遺伝子を持っているが、その中のいくつかは機能がまだ解明されていない。ところが、ヒトには、「未解明な光受容能」は、明確には存在しない。つまり、動物の光受容の全体像を理解するためには、光受容タンパク質を出発点に解析をすることが最も有効な方法の1つであると考えられる。そこで私たちは、多様なロドプシン類の性状・特徴とその分子特性をもたらす構造学的なメカニズムを明らかにすることにより、動物が持つ多様な光受容能を、ロドプシン類の分子進化と関連づけながら、理解することをめざしている。
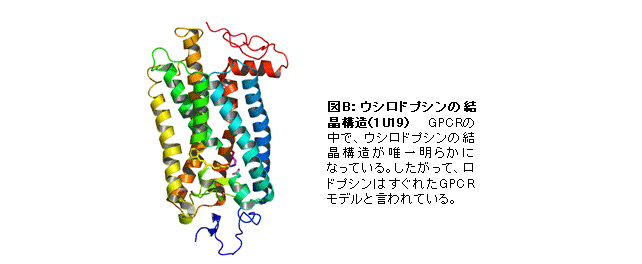
また、ロドプシン類は、創薬のターゲットとして注目されている7回膜貫通構造を持つG蛋白質共役受容体(GPCR)の一種であり、結晶構造が決定され(図B)、GPCR研究のトップランナーの1つと位置づけられている。したがって、多様なロドプシン類の分子特性を利用すれば、刺激受容からGタンパク質の活性化に至るGPCRの機能発現の分子メカニズムの解明を進めることができると考えられる。現在、GPCRによるG蛋白質活性化機構の一般性と多様性を理解するために、新規ロドプシン類を新たなGPCRモデルとした解析を進めている。
研究では、新規ロドプシン類やGタンパク質などの遺伝子クローニング、それらの組織化学的解析、分子進化学的解析、動物培養細胞により作製した部位特異的変異タンパク質の作製、それらの生化学的・分光学的解析、遺伝子改変動物(細胞)の作製と解析など、多種多様な方法を用いている。
これまでの主な研究
これまでの研究は、①ロドプシン類の多様性と分子機能・特性の連関を解析し、分子機能・特性やその発現メカニズムを分子進化や生体機能と関連づけて解明したこと、②GPCRによるG蛋白質活性化機構の一般化のために、ロドプシン類と他のGPCRとの類似点・相違点を明らかにしたことに大別できる。
【①ロドプシン類の多様性と分子機能・特性との連関】
①—1 新規ロドプシン類の発見 ▲このページのトップへ
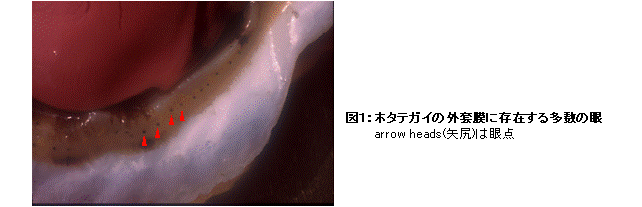
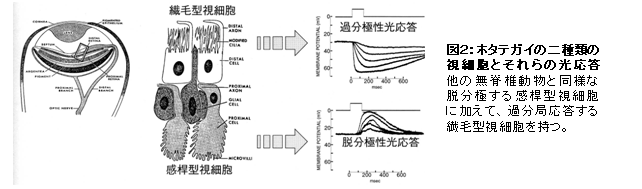
ロドプシンやそれと類似した光受容蛋白質(以後ロドプシン類と記す)は、視覚や体内時計の光調節などの“光受容”という機能の入口に位置するので、ロドプシン類の分子性状の多様性は光受容という生体機能や細胞機能と密接に関連していると考えられる。逆に言えば、異なる色の光に応答したり、光に対して異なる応答特性を示したりする光受容細胞には、異なるロドプシン類が存在すると想像できる。ホタテガイの外套膜に存在する多数の眼(図1)には、一般の無脊椎動物と類似した細胞に加えて、それとは形態的な特徴や電気的応答の特性が異なるもう1種類の光受容細胞が存在する(図2)。
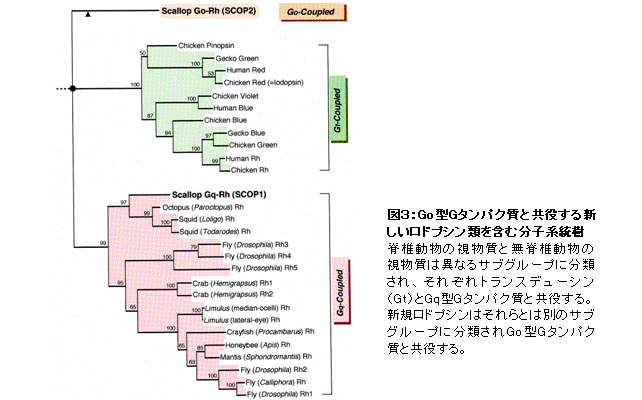
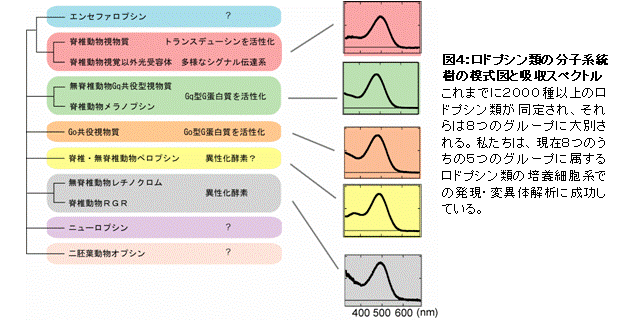
そこで、ロドプシン類の多様性研究を展開したところ、Go型G蛋白質と共役する新規ロドプシン等を発見した(図3)(Kojima et al., J. Biol. Cem. 1997)。この新規ロドプシンの発見以前は、「脊椎動物の視物質ロドプシンと近縁なロドプシン類」と「無脊椎動物視物質に近縁のロドプシン類」の2種類しか知られていなかったので、新規Goロドプシンの発見はロドプシン類と光シグナル伝達系の多様性の存在を意味した。また、この発見は、「ロドプシン類の多様化は脊椎動物と無脊椎動物の分岐と関連する」のではなく、「ロドプシン類の多様化は脊椎動物と無脊椎動物の分岐以前に起こり、分子構造の多様化は分子機能の多様化と相関する」ことを示した。この考えは、ロドプシンの多様性を考える際の基礎となっている。その後、この新規ロドプシンのホモログを脊索動物(脊椎動物に最も近縁な無脊椎動物)のナメクジウオでも見いだしている(Koyanagi et al., FEBS Lett., 2002)。現在では、Goロドプシンを含め、2000種類以上のロドプシン類が同定されており、多様なロドプシン類は分子機能・特性と対応させ大きく8つのサブグループに分類される(図4)。
①—2 多様なロドプシン類の発現系の確立 ▲このページのトップへ
視覚以外で機能しているロドプシン類は生体内に微量しか存在しないために、生体から直接単離して分析するのが困難であり、分子機能や特性は不明なものが多い。しかし、ロドプシン類の多様性を理解するには、アミノ酸配列から多様性を眺めるだけではなく、それぞれのロドプシン類がどのような性質や特性を持っているのかを明らかにし、それらの分子性状や特性を比較なくてはならい。さらに、変異タンパク質を用いた分子進化を再現またはさかのぶるような解析を行い、タンパク質の性質や性状の多様性がどのような分子機構によりもたらされたのかを解明することは興味深いことである。そのためには、多様なロドプシン類やそれらの変異タンパク質を培養細胞系で発現させ、解析することが必須である。そこで、私たちは、それぞれのサブグループに属するロドプシン類を培養細胞中で強制発現させる系を確立し、分子機能や特性の解析を初めて可能にした。これまでに、8つのサブグループ中の5つのサブグループの培養細胞系での発現・解析に成功し、独創的な研究を展開している(図4)。
また、残りの3種類についても発現系の確立を精力的に試みているところである。また、後述するように、脊椎動物の視覚以外の光受容体グループについても、精力的に研究を展開し、これまでに下等脊椎動物松果体で機能しているパラピノプシン(Koyanagi, Kawano et al., Proc. Natl. Acad. Sci. USA, 2004)やトカゲの頭頂眼で機能しているパリエトオプシン(Su et al., Science, 2006)を培養細胞系での発現と機能解析に成功している。
①−3 多様なロドプシンの比較解析:対イオンの変位とロドプシン類の分子進化 ▲このページのトップへ
多様なロドプシン類が発現可能となったことは、これまで不可能であった「多様なロドプシン類の比較解析」を可能とした。多様なロドプシン類の多くは、可視光を受容し、機能を発現する。そこで、最も基本的な可視光受容のメカニズムを多様なロドプシン類間で比較した。
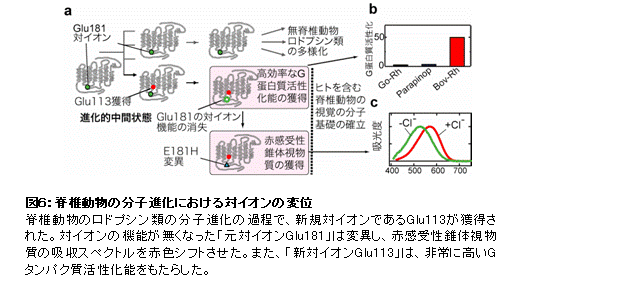
発色団レチナールはUV光しか受容できないが、ロドプシン分子の中には対イオンと呼ばれる特別なアミノ酸残基が存在し、レチナールによる可視光の受容を可能にしている。多くのロドプシン類が持つ可視光受容能に注目し、長年の課題であった多様なロドプシン類の対イオンの決定を網羅的な変異体解析により試みた。その結果、脊椎動物視物質グループの対イオンはN末端から113番目のグルタミン酸(Glu113)であるが、それ以外のロドプシン類ではGlu181が対イオンであり、脊椎動物視物質の先祖型においてGlu113対イオンが新規に獲得されたことを見出した(図5)(Terakita et al., Proc. Natl. Acad. Sci. USA, 2000; Terakita et al., Nat. Struct. Mol. Biol., 2004)。
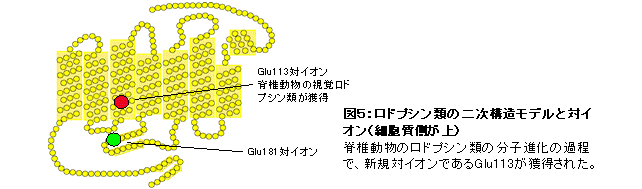
さらなる解析の結果、新規に獲得されたGlu113対イオンは、可視光受容を担う対イオンとしてのみならず、活性化状態を作り出す分子スイッチとしても働き、脊椎動物視物質のみが持つ光退色した特別な活性化状態とそれに起因する高効率なG蛋白質の活性化能力をもたらすと考えられた。また対イオンとしての役割が無くなった「“元”対イオンGlu181」にはアミノ酸置換が起こり、ヒトを含めた脊椎動物の赤感受性の色覚色素の誕生をもたらしたなど、ロドプシン類の分子進化における対イオンの変位は脊椎動物の視覚・色覚の分子基盤の第一歩であったと言える(図6)。
①−4 Bistable pigmentの解析 ▲このページのトップへ
ヒトを含めた脊椎動物の視物質は光受容すると不安定な光産物を生成し、発色団を遊離し、退色する。一方、無脊椎動物の視物質は安定な光産物を生成し、この光産物が再び光を吸収するともとの状態に戻る。暗状態と光産物の2状態が安定であることから、後者をbistable (2状態安定)ロドプシン類と呼ぶ。また、退色する前者のロドプシン類を退色型ロドプシン類と呼ぶ。多様なロドプシン類の解析を通して、分子性状として、脊椎動物の視物質とその近縁のロドプシン類のみが退色型であり、脊椎動物視物質と近縁であってもパラピノプシンのように視覚以外で働くロドプシン類の中には、bistable ロドプシン類が含まれていることが分かった。これまで困難であった網膜以外の光受容細胞や光受容器官で機能しているbistableロドプシン類の解析に成功し、興味深い発見をした。次に、2つの例を紹介する。
<眼外UV光受容タンパク質パラピノプシン>
下等脊椎動物の松果体は紫外光(UV)と可視光(緑)の比率を検出していることが知られており、そこには眼とは異なるUV受容メカニズムの存在が示唆されていた(図7)。

私たちは、ヤツメウナギの松果体において錐体UV視物質とは進化的、機能的に異なるUV受容蛋白質が機能していることを示した(Koyanagi, Kawano et al., Proc. Natl. Acad. Sci. USA, 2004)。この新規松果体UV受容蛋白質は、従来の錐体UV視物質がUV光を吸収すると退色するのとは異なり、UV光の吸収によって可視部に吸収を持つ安定な照射産物へと変化し、そしてさらにこの照射産物に可視光を照射すると元のUV受容蛋白質へ戻るという光再生能を持つことがわかった(図8)。
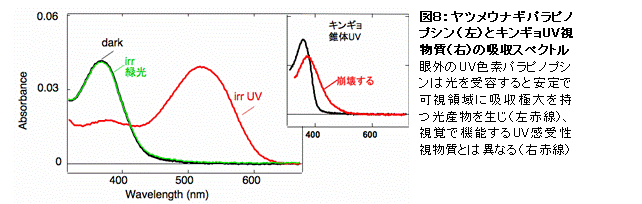
この松果体UV受容蛋白質の光再生能は、松果体におけるUV感受性の光回復という生理現象を生み出していると考えられる。
<概日リズムの光受容タンパク質メラノプシン>
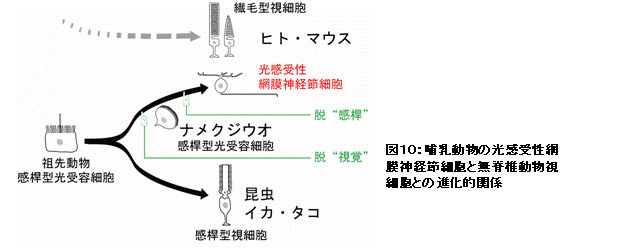
ヒトを含む哺乳類では、目から入ってくる光情報を視覚として感じるだけでなく、生体リズムの調節にも利用している。視覚の場合、光は目に存在する視細胞でキャッチされるが、体内時計の調節では、光は視細胞とは別の“光感受性神経節細胞”によりキャッチされる(図9)。
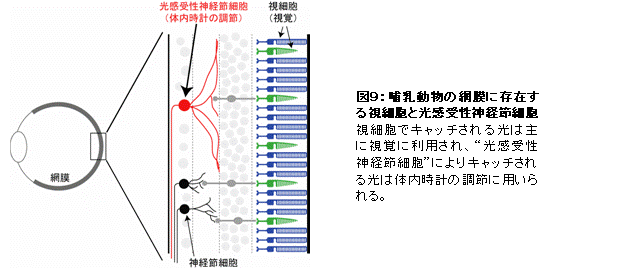
その体内時計の光受容は、光感受性神経節細胞に存在するメラノプシンという光受容蛋白質によりなされており、メラノプシンの機能解析は国際的に熾烈な競争となっていた。私たちは、脊椎動物のに最も近縁な動物の一つである頭索動物ナメクジウオのメラノプシンの機能解析に初めて成功し、光受容細胞の性質の基礎となるメラノプシンの光反応特性や光情報の伝達システムが、哺乳類の視細胞のシステムとは全く異なり、昆虫やイカ、タコの視細胞のものと極めて類似していることを明らかにした(Koyanagi et al., Curr. Biol., 2005)。これは、哺乳類の体内時計の光センサーである神経節細胞が、無脊椎動物の視細胞と起源を同じにするという驚くべき進化のシナリオ(図10)を強く示唆する結果である。つまり、ヒトを含む哺乳類の目の中には、視覚を司る視細胞の他に無脊椎動物の視細胞タイプの細胞が形態を変化させて体内時計の調整のために同居していると言える。