
最新の研究成果
パセリ油の不飽和脂肪酸が黄色ブドウ球菌の病原因子を阻害するメカニズムを解明
2024年5月21日
- 生活科学研究科
- プレスリリース
ポイント
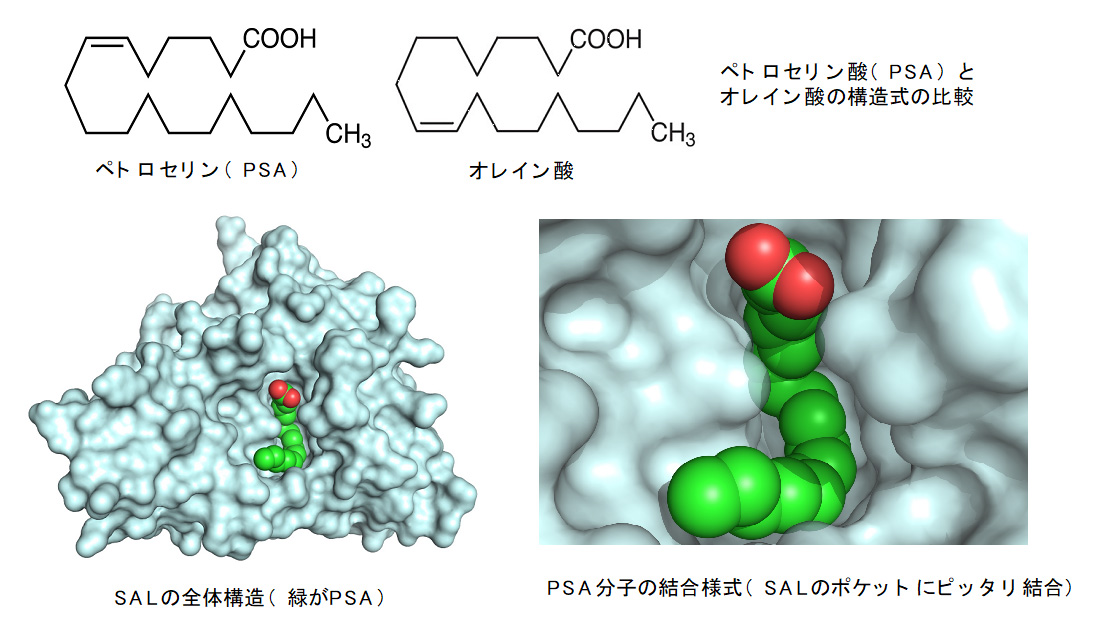
◇黄色ブドウ球菌※1の病原因子「リパーゼ(SAL)」とパセリ油の主成分であるペトロセリン酸(PSA)の複合体の立体構造を世界で初めて解明した。
◇不飽和脂肪酸※2PSAのSALへのIC50※3値が3.4 μMと非常に強いことを明らかとするとともに、不飽和脂肪酸の二重結合が酵素の活性部位に結合することを見出した。
◇PSAのようなSAL阻害剤は、既存の抗菌薬の効かないMRSA感染症※4や、黄色ブドウ球菌により引き起こされるアトピー性皮膚炎などの治療薬になることが期待できる。またヒトのリパーゼへの阻害の可能性も示唆されることから、抗肥満薬への適応も期待される。
概要
京都工芸繊維大学分子化学系の北所健悟准教授らの研究グループは、大阪公立大学大学院生活科学研究科の神谷重樹教授、京都大学大学院医学研究科医学研究支援センターの奥野友紀子特定准教授、理化学研究所放射光科学研究センター利用システム開発研究部門の引間孝明研究員、山本雅貴部門長、筑波大学医療医学系の広川貴次教授らとの共同研究により、黄色ブドウ球菌が産生する病原因子の1つである「リパーゼ(SAL)」とパセリから抽出される不飽和脂肪酸のペトロセリン酸(PSA)との複合体の立体構造をX線構造解析※5の方法を用いて、世界で初めて解明しました。
不飽和脂肪酸「PSA」が既存のSAL阻害剤と同等のレベルでSALの活性を阻害することを発見しました。更に、SALとPSAとの複合体の構造を原子レベルで解析することによって、PSAによる阻害のメカニズムを解明することに成功しました。
本研究成果は、構造情報を元にしたSALに対する薬剤の理論的な開発に役立つと考えられ、より有効性が高く副作用の少ない治療薬の探索・設計が可能になると期待されます。特に、SALが黄色ブドウ球菌の増殖に関与していることから既存の抗菌薬の効かないMRSA感染症や、黄色ブドウ球菌によって引き起こされるアトピー性皮膚炎などの治療薬の発展が期待されます。また不飽和脂肪酸による酵素の阻害メカニズムが解明されたことから、PSAによるヒトリパーゼへの阻害の可能性と抗肥満薬への適応の可能性が示唆されました。なお、本研究成果は、2024年5月16日付けで「FEBS OpenBio」のオンライン版 (https://febs.onlinelibrary.wiley.com/doi/full/10.1002/2211-5463.13808) に掲載されました。
掲載誌情報
【発表雑誌】FEBS OpenBio
【論文名】Crystal structure of Staphylococcus aureus lipase complex with unsaturated petroselinic acid
【著者】Kengo Kitadokoro, Shigeki Kamitani, Yukiko Okuno, Takaaki Hikima, Masaki Yamamoto, Takatsugu Hirokawa
【掲載URL】https://doi.org/10.1002/2211-5463.13808
用語解説
※1 黄色ブドウ球菌(Staphylococcus aureus;SA菌)…ヒトの鼻腔などに存在する常在菌で、化膿した傷口の膿の部分に多く存在し、感染症の原因となる多くの毒素タンパク質や酵素などの病原因子を産生します。病原性が強い菌で、基礎疾患のある人など、免疫力の低下した患者に対して、肺炎、敗血症、骨髄炎、関節炎などの重篤な感染症を引き起こします。
※2 不飽和脂肪酸…カルボン酸を末端に持つアルキル基のうち、分子内に二重結合を持つものの総称です。オリーブオイルに含まれるオレイン酸が有名ですが、健康に良いとされているそのメカニズムは不明な点が多いです。
※3 IC50値(half maximal (50%) inhibitory concentration;50%阻害濃度または半数阻害濃度)…化合物の生化学的な阻害作用の有効度合いを示す値です。数値が低いほど阻害が有効であることを表します。数値として示した濃度で薬物が、標的とする酵素の半数の働きを阻害できることを示しています。
※4 MRSA(Methicillin-resistant Staphylococcus aureus)感染症…メチシリンなどのペニシリン剤やβラクタム剤など多くの抗生物質が効かない耐性を持った黄色ブドウ球菌によって引き起こされた感染症で、幼児や高齢者など免疫力が低下した患者が感染すると、多くの種類の抗菌薬が効かないために、治療が進まずに重症化し、死に至るケースがあります。
※5 X線構造解析…タンパク質の立体構造を決定する手法で、ターゲットとなるタンパク質を結晶化し、大型放射光施設「SPring-8(スプリングエイト)」などの強いビームを使って、X線照射して得られた回折データから、タンパク質の原子レベルでの立体構造を解析します。
研究内容に関する問い合わせ先
大阪公立大学大学院生活科学研究科
教授 神谷 重樹(かみたに しげき)
E-mail:skami[at]omu.ac.jp
※[at]を@に変更してください。
報道に関する問い合わせ先
大阪公立大学 広報課
担当:永田
TEL:06-6605-3411
E-mail:koho-list[at]ml.omu.ac.jp
※[at]を@に変更してください。
該当するSDGs

