最新の研究成果
マイコプラズマの滑走運動に必要なモーターの分子構造を世界で初めて明らかに!
2025年3月4日
- 理学研究科
- プレスリリース
概要
マイコプラズマ属細菌の一つで淡水魚の病原菌であるマイコプラズマ・モービレは、菌体の片側にある“滑走装置”を用いて宿主組織の表面にはりつき、滑るように動く“滑走運動”を行います。
大阪公立大学大学院理学研究科の宮田 真人教授、豊永 拓真助教(研究当時、現在 東北大学多元物質科学研究所 助教)らと大阪大学大学院生命機能研究科日本電子YOKOGUSHI協働研究所の難波 啓一特任教授(常勤)、理化学研究所の川上 恵典研究員、東北大学多元物質科学研究所の濵口 祐准教授らの共同研究グループは、大阪大学のクライオ電子顕微鏡※1を用いて、滑走運動の装置を構成するモーター部分の分子構造を、世界で初めて近原子分解能※2で明らかにしました(図1)。またモーターを構成する2つのユニットの分子構造は、それぞれ既知のATP合成酵素※3と類似しているものの、それらが組み合わさって前例のない複合体構造を形成していることが分かりました。本成果は、ATP合成酵素とマイコプラズマの運動装置の進化についてさらなる理解を促進するとともに、マイコプラズマ感染症の治療薬開発の基盤知見となることが期待されます。
本研究成果は、2025年2月27日に、国際学術誌「Science Advances」のオンライン速報版に掲載されました。
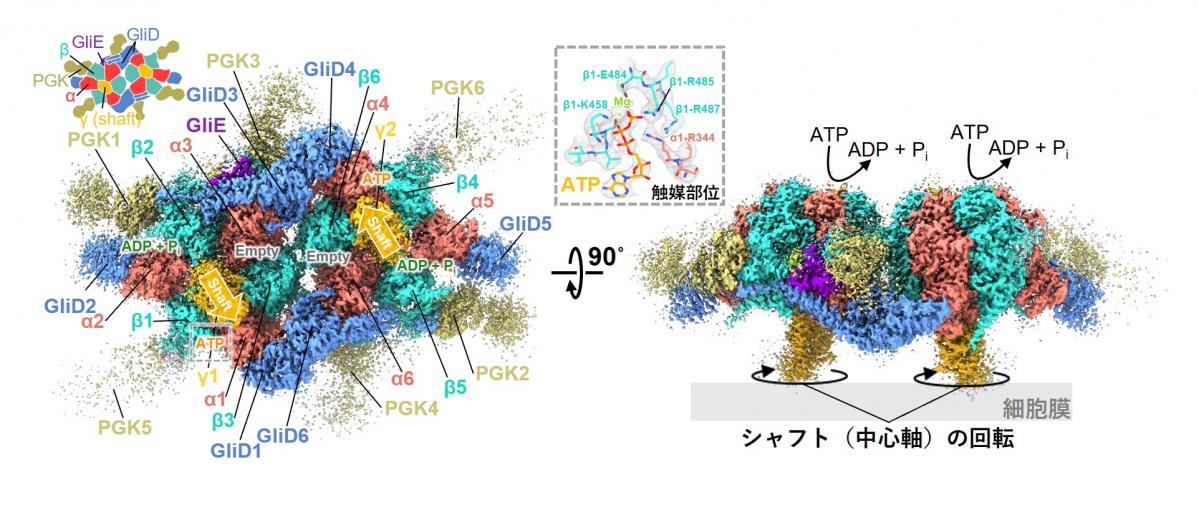 図1 本研究で明らかになった滑走装置のモーターを構成する2つのユニットの分子構造
図1 本研究で明らかになった滑走装置のモーターを構成する2つのユニットの分子構造
掲載誌情報
【発表雑誌】Science Advances
【論文名】Dimeric assembly of F1-like ATPase for the gliding motility of Mycoplasma
【著者】Takuma Toyonaga(大阪公大), Takayuki Kato(大阪大), Akihiro Kawamoto(大阪大), Tomoko Miyata(大阪大), Keisuke Kawakami(理研), Junso Fujita(大阪大), Tasuku Hamaguchi(東北大), Keiichi Namba(大阪大),Makoto Miyata(大阪公大)
【掲載URL】https://doi.org/10.1126/sciadv.adr9319
資金情報
本研究は、JSPS科研費 基盤(A)(JP17H01544)、JST CREST(PMJCR19S5)、AMED BINDS(JP22am121003)からの助成を受けて実施しました。また、モーターの構造解析には、大阪大学JEOL YOKOGUSHI 提携研究所のクライオ電子顕微鏡を用いました。
用語解説
※1 クライオ電子顕微鏡…タンパク質などの生体分子を水溶液中の生理的な環境に近い状態で、電子顕微鏡で観察するために開発された手法。試料を含む溶液を液体エタン(約-180℃)に落下させて急速凍結し、アモルファス(非晶質、ガラス状)な薄い氷に包埋し、これを液体窒素(-196℃)条件下で、透過型電子顕微鏡で観察する。電子顕微鏡内の真空中で試料は凍結状態を保持でき、また、冷却することにより電子線の照射による損傷を減らすことができる。
※2 近原子分解能…分解能はどのくらい細かくものを「見る」ことができるかの指標で、数値が小さい程分解能が高いといえ、物質をより精細に観測できる。近原子分解能は、個々の原子を区別できるほどに迫る分解能を指す。
※3 ATP合成酵素…ほとんどの生物に存在するナノスケールの回転分子モーター。真核生物のミトコンドリア内膜や細菌の細胞膜において、水素イオンの流れを回転エネルギーに変換し、その回転によって「生命のエネルギー通貨」であるATPを合成する。
関連情報
世界初!ATP合成酵素から変化した滑走のツインモーターの構造を明らかに(2021年07月16日 大阪市立大学プレスリリース)
研究紹介動画
論文,Dimeric assembly of F1-like ATPase for the gliding motility of Mycoplasmaの説明(大阪公立大学大学院理学研究科細胞機能学研究室 マイコプラズマグループYouTubeチャンネル)
研究内容に関する問い合わせ先
大阪公立大学大学院理学研究科
教授 宮田 真人(みやた まこと)
TEL:080-3118-2060
E-mail:miyata[at]omu.ac.jp
※[at]を@に変更してください。
報道に関する問い合わせ先
大阪公立大学 広報課
担当:竹内
TEL:06-6967-1834
E-mail:koho-list[at]ml.omu.ac.jp
※[at]を@に変更してください。
該当するSDGs
