研究紹介(中島)
研究内容
タンパク質をベースとする新たなセンサー機構の試み
詳細はこちら
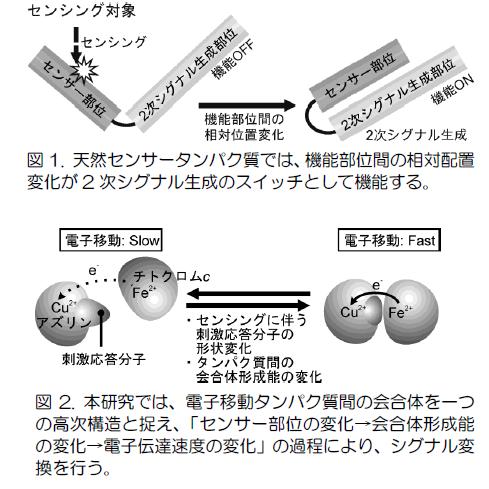
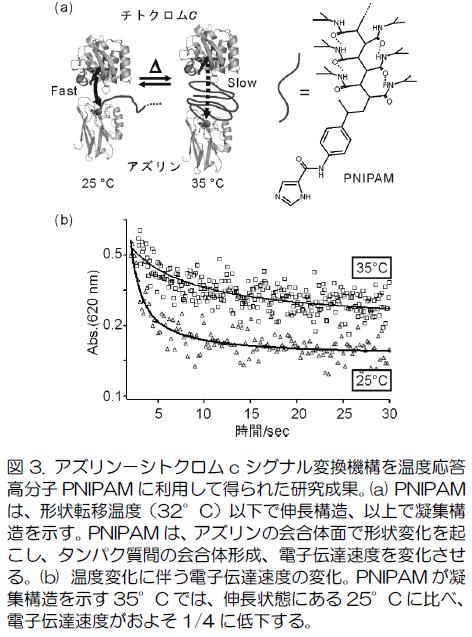
酵素反応をセンシングに利用するバイオセンサーは、酵素の基質認識能を利用するため、選択的な物質検出が可能です。また、生体への適合性も高いことから、様々な分野で活発な利用と研究がなされています(文献1)。一般にセンサーは、物質の有無や環境の変化を感知し、何らかの1次シグナルを生成するセンシング部位と、1次シグナルを計測可能な2次シグナルへと変換するシグナル変換部位から構成されています。2次シグナルには、検出が簡便でデータの加工が容易な電気的シグナルが汎用されていて、酵素を用いるバイオセンサーについてもこの点は変わりません。ただし、酵素にはもともとの機能としてシグナル変換の機能はありませんので、センシング部位で生成する1次シグナル(つまり酵素反応)自体が、電気的シグナルを発生するような場合が多いといえます。つまり、センシング部位に利用される酵素は、酸化還元反応を伴うものが大半を占め、これがバイオセンサーの応用範囲を限定される要因の一つとなっていると考えられます。ところで、天然のセンサータンパク質では、「センシングに伴う1次シグナル(結合の生成・解裂等の反応)の発生→ タンパク質構造の変化→ 2次シグナルの発生」が一般的な動作機構であり、タンパク質の高次構造変化が、シグナルの伝達・変換を担います。天然センサータンパク質を対象とした我々の研究でも明らかにしてきましたが、高次構造変化によるタンパク質におけるシグナル伝達過程とは、センサー部位で生じる局所的な構造変化を起点とする、タンパク質機能部位(ドメイン)間の配置変化であることが数多く報告されています(図1)。こうしたタンパク質高次構造変化を人工的に再現できれば、シグナル伝達機構を有するバイオセンサーを作り出すことが可能となり、バイオセンサー自体の応用範囲が拡大すると考えられます。しかし、天然と同等の仕組みを人工的に単一のタンパク質を用いて分子レベルで設計することは、未だ難問であり、関連する研究への取組みは、国内外を問わずほとんど知られていません(文献2)。 我々は、この問題に対し、センサータンパク質のシグナル変換過程である「分子構造変化」を、特定タンパク質間における「動的な分子間相互作用の変化」として実現することを考案しました。具体的には、一組の電子伝達タンパク質(今のところ、アズリン-チトクロムc)と環境応答性分子からなる動的な相互作用系を構築します(図2)。この系では、電子伝達タンパク質が、電子伝達の過程で生成する一時的な相互作用を一つの「高次構造」と捉えます(思い込みます)。そして、この相互作用をタンパク質(図ではアズリン)に導入した環境応答性分子のセンシング過程に連動させて、変化させます。相互作用の変化は、タンパク質間の電子伝達速度の変化に反映されるため、環境応答性分子によるセンシング過程は、最終的に電気的なシグナルに変換、計測することができるはずです。この系では、電子伝達タンパク質間の相互作用変化がシグナル変換を担うため、センシングに伴って構造変化する様々な環境応答性分子に応用可能だと考えています。これまでの研究ではすでに、熱応答性ポリマーであるポリイソプロピルアクリルアミド(PNIPAM)類縁体を環境応答部位に用いた系の構築に成功しており、PNIPAMの形状転移温度(32C)前後でタンパク質間の電子伝達速度に明確な変化が生じることを確認しています(図3)。現在は、この相互作用系の電極への集積を図り、分子単位で観測される温度依存的な電子伝達速度の変化を電極電流の変化として、計測できる仕組みへのビルドアップを進めています。また、環境応答部位として、PNIPAM等の環境応答性分子に加え、オリゴDNAやペプチドを利用し、この部位に特異的に結合する分子やタンパク質の存在を電子伝達速度の変化、そして、電流値の変化として計測するシステムの構築の実現をめざした研究も行っています。それらを通じて、我々の系が多様な環境応答部位の変化を電気的シグナルへ変換可能な仕組みであることを検証してゆきます。バイオセンサーの応用分野拡大をめざす研究は、現在も活発に行われていますが、主な成果は、センサーに適応可能な新たな酵素の発見や、酵素反応生成物を検出するための電極材料の工夫に集中しています。これらは、ほとんどが既存のバイオセンサーの構造(シグナル変換機能がタンパク質部分に存在しない)を前提としています(本業の方々からは、違う!と怒られるかもしれませんが)。我々のアプローチは、天然センサータンパク質の「構造変化を介したシグナル変換の仕組み」に着想を得、そのエッセンスを様々なバイオセンサーに応用可能な、簡便な相互作用系(アズリン/チトクロムc電子伝達系)で再現することを目的としており、従来からの研究とは異なる発想に基づくものであると考えています。ケミカルバイオロジーに欠かせないDNA、ペプチドチップの検出方法は、現在、蛍光など光学的手法が主流であるが、本系を応用すれば、検出結果を電気的な信号として直接計測することもできるようになるかもしれません。引用文献) 1. L. Murphy et al., Biosensors and bioelectrochemistry, Curr. Opin. Chem. Biol. 2006, 10, 177. 2. 数少ない例として、Benson, D. E., Conrad, D. W., de Lorimier, R. M., Trammell, S. A., Hellinga, H.W., Science 2001, 293, 1641. 関連する我々の論文より) 1. Azurin-Poly(N-isopropylacrylamide) Conjugates by Site-Directed Mutagenesis and their Temperature Dependent Behavior in Electron Transfer Processes Angew. Chem. Int. Ed. 2009, 48, 1946-1949, Rosenberger N., Studer A., Takatani N., Nakajima H., Watanabe Y. アズリンに固定した温度応答性ポリマー(PNIPAM)はアズリン上でも温度依存的な構造変化を示す。この構造変化がアズリンとシトクロムcの相互作用に摂動を与えることで、タンパク質間の電子伝達速度が変化する。 2. Azurin-DNA Conjugate with Binding Motif of a Transcriptional Regulator, CooA: CO Dependent Modulation of Electron Transfer Reaction, Chem. Lett. 2014, 43, 1204-1206, Nakajima H., Miyazaki S., Itoh T., Hayamura M. Watanabe Y. 2009年ACIEの展開研究です。ここでは、PNIPAMの代わりにDNA+転写制御因子の組み合わせを用い、転写制御因子が外部刺激を感知した際に生じるDNAに対する結合能の変化を電子伝達タンパク質間の電子移動速度の変化へと変換することに成功しています。現在は、この仕組みを応用し、転写制御因子を素子に用いるバイオセンサーの開発を進めています。
 |
 |