研究内容


研究内容
腸管粘膜固有層の自然免疫細胞群の解析
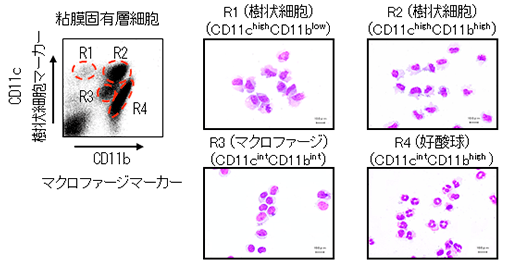
腸管粘膜固有層から細胞を単離する技術を確立しました。粘膜固有層の自然免疫細胞群が、マクロファージマーカーであるCD11bと樹状細胞マーカーであるCD11cの発現によって、4つのサブセット:2種類の樹状細胞(CD11chighCD11blowとCD11chighCD11bhigh)、マクロファージ(CD11cintCD11bint)、好酸球(CD11cintCD11bhigh)に分かれる事を報告しました(Uematsu S*, Fujimoto K*, et al. Nat Immunol. 2008 (*equal contribution).) 。
1)腸管粘膜固有層のCD11chighCD11bhighの樹状細胞の解析
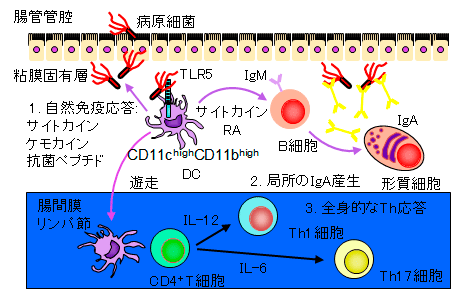
腸管粘膜固有層の細胞は単離が非常に困難なため、どのような細胞が免疫応答を開始し生体防御を誘導するかは分かっていませんでした。細菌の鞭毛構成タンパクのフラジェリンを認識するToll-like receptor (TLR)5が、小腸粘膜固有層のCD11c+細胞に特異的に発現しており、有鞭毛細菌に対して自然免疫応答を誘導することを明らかにしました。一方、有鞭毛で細胞内寄生性の強毒菌であるSalmonella typhimuriumは、TLR5を利用することによって全身に感染を広げることも分かりました(Uematsu S, et al. Nat Immunol. 2006.) 。 そして、粘膜固有層に存在する4つのサブセットのうち、CD11chighCD11bhighの樹状細胞が、特異的にTLR5を発現していました。これらの樹状細胞が、ビタミンA誘導体のレチノイン酸を産生する特殊な能力を持ち、粘膜固有層におけるIgA産生形質細胞の分化や、抗原特異的なCD4+ヘルパーTh1細胞とTh17細胞の分化をTLR5刺激依存的に誘導することを明らかにしました (Uematsu S*, Fujimoto K*, et al. Nat Immunol. 2008. (*equal contribution))。 CD11chighCD11bhigh樹状細胞は、感染防御に重要な腸管粘膜のIgA産生に必須の細胞であり、細胞性免疫に重要なTh1細胞の誘導に関わることから、経口粘膜ワクチンや癌免疫療法のよい標的細胞になることが考えられます。今後、 CD11chighCD11bhigh樹状細胞のヒトカウンターパートの同定と機能解析を行う予定です。また、CD11chighCD11bhigh樹状細胞によって誘導される抗原特異的なTh17細胞が、腸管の恒常性維持や免疫応答においてどの様な役割を果たすか明らかにしたいと考えています。(CD11chighCD11blowとCD11chighCD11bhigh)、マクロファージ(CD11cintCD11bint)、好酸球(CD11cintCD11bhigh)に分かれる事を報告しました(Uematsu S*, Fujimoto K*, et al. Nat Immunol. 2008 (*equal contribution).) 。
2)腸管粘膜固有層のCD11chighCD11blowの樹状細胞の解析
CD103+樹状細胞は、小腸粘膜固有層や腸管膜リンパ節において代表的な抗原提示細胞です。CD103+ 樹状細胞はレチノイン酸を産生し、TGF-β存在下にFoxp3+制御性T細胞を誘導することが報告されました。このことから、CD103+ DCは経口免疫寛容の誘導に重要で、抑制性の細胞であり、単一サブセットであると考えられていました。
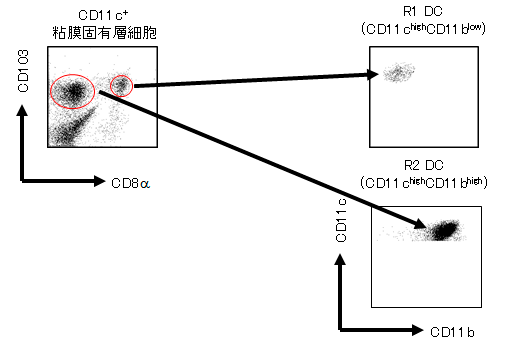
私たちの解析から、CD103+ 樹状細胞はCD8αの発現によって、2つのサブセットも分かれることが明らかになりました(Fujimoto K*, Karuppuchamy T*, et al. J. Immunol. 2011. (*equal contribution))。そして、CD103+CD8α+樹状細胞は、CD11chighCD11blowサブセットに、CD103+CD8α-樹状細胞は、CD11chighCD11bhighサブセットに対応していることが分かりました。CD11chighCD11blow樹状細胞は、TLR3,7,9を発現していてTh1応答、抗原特異的IgG、細胞傷害性T細胞活性を誘導しました。一方、CD11chighCD11bhigh樹状細胞はTLR5,9を発現し、Th1とTh17応答、IgA産生、強い細胞傷害性T細胞活性を誘導しました。レチノイン酸産生能があるのは、CD8α-のCD11chighCD11bhigh樹状細胞で、TGF-β存在下にTLRリガンドで未刺激時にFoxp3+制御性T細胞を誘導するのはこちらのサブセットであることが分かりました。
3)次世代粘膜ワクチンの開発
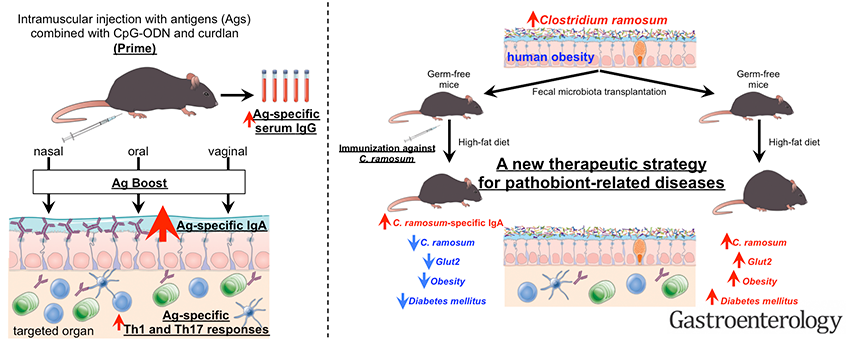
当研究室では、これまでの腸管粘膜固有層の特異的な樹状細胞の解析を基盤として、次世代粘膜ワクチンの開発を行っています。注射によるワクチン投与であるにも関わらず、全身免疫だけでなく腸管において抗原特異的IgAを誘導できる粘膜アジュバントを発見しました。この粘膜アジュバントを用いた初期免疫後、経口、経気道、経膣に抗原のみを追加免疫することで非常に高力価の抗原特異的sIgAを長期間誘導できます。この免疫法は「ワクチン用アジュバント、ワクチン、及び免疫誘導方法」に関する技術として2019年5月に特許化されました(WO/2016/199904)。このワクチンは、病原体の侵入門戸である粘膜において強力な粘膜免疫応答を誘導でき、「発症する前に抑制する」全く新しいコンセプトのワクチン開発が期待されます。また、このワクチンの方法を疾患特異的な腸内細菌を標的として応用することで、これまで制御できなかった腸内細菌叢の乱れに関連するさまざまな難治性の疾患に対する新たな治療アプローチとして使える可能性が期待されます(Fujimoto K*, Kawaguchi Y*, Shimohigoshi M*, et al. Gastroenterology. 2019. (*equal contribution))。現在、このワクチン接種法を次世代粘膜ワクチンとして、ヒトへの応用を進めています。
4)腸管粘膜固有層のマクロファージ、好酸球の解析
CD11cintCD11bintのマクロファージの解析を行っています。これらは、ケモカイン受容体のCX3CR1を発現しております。これらのTLRの発現、サイトカイン産生、免疫制御、炎症、感染症における役割を検討しています。
CD11cintCD11bhighの好酸球の解析を行っています。小腸には好酸球が大量に存在していることが報告されていますが、その機能に関しては詳細に調べられていません。現在、好酸球の活性化機構、寄生虫感染における役割、炎症、アレルギー応答などを中心に解析を進めています。
CD11cintCD11bhighの好酸球の解析を行っています。小腸には好酸球が大量に存在していることが報告されていますが、その機能に関しては詳細に調べられていません。現在、好酸球の活性化機構、寄生虫感染における役割、炎症、アレルギー応答などを中心に解析を進めています。
放射線腸障害における自然免疫の役割
1)急性放射線消化管症候群におけるTLR3の役割
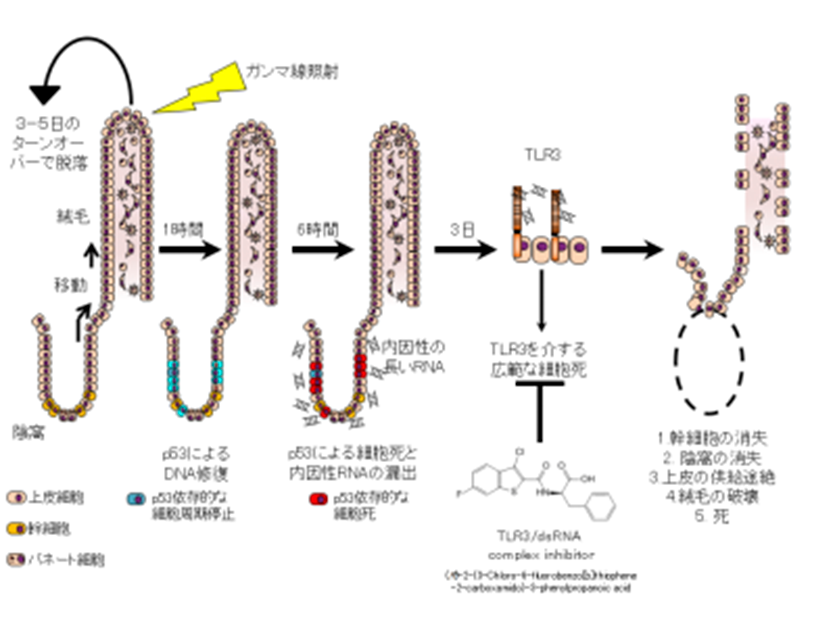
急性放射線症候群は、高線量の電離放射線に曝露後に起こる急性疾患です。急性放射線症候群では、各臓器の放射線に対する感受性に従ってさまざまな症状が出現します。1.5 Gy以上の全身被曝では、体内で最も感受性の高い造血幹細胞が傷害され、血小板や白血球の供給が途絶えるために出血傾向と免疫力低下が誘導されます(造血症候群)。5 Gy以上では、消化管の腸管傷害が誘導され、下痢、吸収低下、細菌性腸炎によって亜急性に死亡します(消化管症候群)。この放射線誘導性の消化管症候群は、定説よれば陰窩(いんか)の上皮幹細胞が細胞死を起こすことによって発生します。具体的には電離放射線によって、宿主のDNAが傷害されると、癌抑制遺伝子のp53が細胞周期を停止させ、DNA修復を行います。しかし、DNAの傷害が修復不可能である場合には、p53は細胞死を誘導する。このような分子メカニズムに基づくと、放射線誘導性の細胞死を阻害する薬剤が消化管症候群の治療に有効と考えられますが、p53遺伝子を阻害する薬剤を用いた治療応用は、傷害されたDNAが修復可能な場合にまで影響を及ぼすため現実的でなく、有効な治療法が存在していませんでした。
我々は、ウイルスの2本鎖RNAを認識して自然免疫応答を誘導するTLR3と呼ばれるタンパク質を欠損する遺伝子改変マウス(TLR3欠損マウス)が急性放射線症候群に抵抗性を示すことを見出しました。急性放射線症候群のうち、TLR3欠損マウスでは造血症候群には変化が認められなかったが、消化管症候群では致死率、下痢、体重減少といった症状が有意に軽度でした。放射線で誘導される陰窩の細胞死がTLR3欠損マウスでは抑制されており、そのため生き残った陰窩から上皮幹細胞が供給されて絨毛構造は破綻せずに生存できることが明らかになりました。興味深いことに、p53による細胞死はTLR3欠損マウスでは正常に起こっていました。p53によって細胞死を起こした細胞からRNAが漏出しており、それがTLR3を介して広範な陰窩の細胞死を誘導していることが明らかになりました。さらに、最近発売されたTLR3-RNA結合阻害剤((R)-2-(3-chloro-6-fluorobenzo [b] thiophene-2-carboxamido)-3-phenylpropanoic acid)を、放射線誘導性の消化管症候群を患ったマウスに投与したところ、陰窩の細胞死が抑制され、マウスの致死率も有意に改善しました。本研究の成果により、TLR3の活性を阻害することは、放射線障害誘導性消化管症候群の新しい治療標的となることが明らかになりました。
これらの成果は、原発事故などで被曝した患者さんの消化管症候群の新規治療法になるとともに、癌治療のための腹部放射線照射の際の副作用として生じる消化管障害の治療法としても期待されます(Takemura N, et al. Nat Commun. 2014.)。
我々は、ウイルスの2本鎖RNAを認識して自然免疫応答を誘導するTLR3と呼ばれるタンパク質を欠損する遺伝子改変マウス(TLR3欠損マウス)が急性放射線症候群に抵抗性を示すことを見出しました。急性放射線症候群のうち、TLR3欠損マウスでは造血症候群には変化が認められなかったが、消化管症候群では致死率、下痢、体重減少といった症状が有意に軽度でした。放射線で誘導される陰窩の細胞死がTLR3欠損マウスでは抑制されており、そのため生き残った陰窩から上皮幹細胞が供給されて絨毛構造は破綻せずに生存できることが明らかになりました。興味深いことに、p53による細胞死はTLR3欠損マウスでは正常に起こっていました。p53によって細胞死を起こした細胞からRNAが漏出しており、それがTLR3を介して広範な陰窩の細胞死を誘導していることが明らかになりました。さらに、最近発売されたTLR3-RNA結合阻害剤((R)-2-(3-chloro-6-fluorobenzo [b] thiophene-2-carboxamido)-3-phenylpropanoic acid)を、放射線誘導性の消化管症候群を患ったマウスに投与したところ、陰窩の細胞死が抑制され、マウスの致死率も有意に改善しました。本研究の成果により、TLR3の活性を阻害することは、放射線障害誘導性消化管症候群の新しい治療標的となることが明らかになりました。
これらの成果は、原発事故などで被曝した患者さんの消化管症候群の新規治療法になるとともに、癌治療のための腹部放射線照射の際の副作用として生じる消化管障害の治療法としても期待されます(Takemura N, et al. Nat Commun. 2014.)。
2)放射線誘導性線維症の治療法の開発
放射線誘発性腸線維症は、骨盤内腫瘍または腹膜転移のための腹部放射線療法後の重篤な合併症で、特に小腸の粘膜下組織に顕著な線維化を引き起こします。この病態には、粘膜下組織での活性化好酸球の過剰浸潤が関連していました。腹部放射線照射後、腸管陰窩では慢性の細胞死が誘導された結果、細胞外にアデノシン三リン酸 (ATP)の漏出を引き起こし、陰窩直下の筋線維芽細胞を活性化させました。この活性化筋線維芽細胞は、粘膜下に好酸球を浸潤させるとともに、活性化させることが分かりました。粘膜下の活性化した好酸球は、TGF-βの産生 を介して、逆に筋線維芽細胞からのコラーゲン産生を促し、 粘膜下に著明な線維化を誘導することが明らかになりました。今回、協和発酵キリン株式会社との共同研究において、新規にマウスInterleukin (IL)-5 receptor(R)αを標的とした好酸球除去抗体を開発しました。この抗体の投与によって、腸管の好酸球浸潤は消失し、放射線誘発性腸線維症は、顕著に改善しました。以上のことから、好酸球を標的とした抗体治療を行うことによって、放射線誘発性腸線維症の新しい治療戦略を示すことができました(Takemura N, et al. Sci Trans Med. 2018.)。
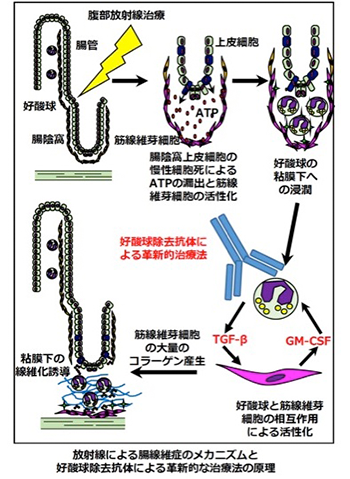
放射線誘発性腸線維症は、腹部放射線治療後に起こる重篤な合併症であり、これまで治療法がありませんでした。好酸球除去抗体の投与は、腸管の線維化を抑制することができ、放射線治療後の患者さんの合併症を防いで、QOL(Quality Of Life)の低下を回避できると考えます。
腸内微生物叢のメタゲノム解析
1)健常者の腸内細菌、ウイルス叢のデータベース構築
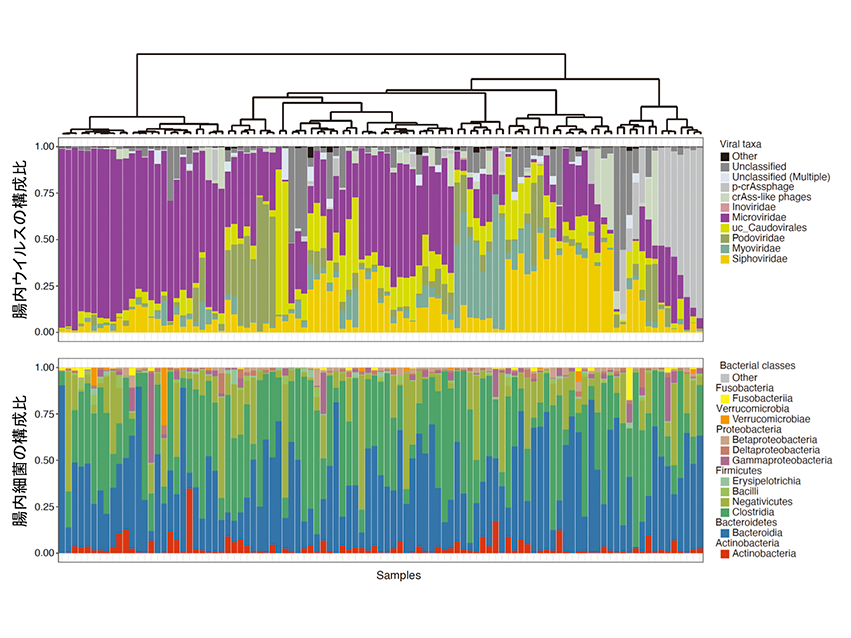
東京大学医科学研究所ヒトゲノム解析センター健康医療インテリジェンス分野の井元清哉教授(ヒトゲノム解析センター長)および東京医科歯科大学M&Dデータ科学センター長宮野悟特任教授との共同研究で、医科学研究所のスーパーコンピュータを使用し、腸内細菌、ウイルス叢の超高速解析パイプラインの構築を行っています。このパイプラインを用いて、日本人健常者の糞便を解析し、世界初の同一糞便における腸内細菌叢とウイルス叢のデータベースの構築を行いました(Fujimoto K, et al.Cell Host & Microbe. 2020.)。腸内ウイルスの多くは腸内細菌に感染するバクテリオファージであることが知られています。この独自のビッグデータならびに解析手法を用いて、シークエンスデータからバクテリオファージの宿主を同定することも可能となりました。
2)疾患メタゲノム解析によるdysbiosis関連疾患の治療法の開発
近年、炎症性腸疾患のような腸管の疾患だけでなく、自己免疫疾患、糖尿病、循環器系疾患、さらに自閉症などでもdysbiosisが存在し、それらが病態と密接に関わっていることが明らかとなりました。当研究室ではdysbiosis関連疾患における腸内細菌、ウイルス叢のメタゲノム解析を行い、病態に関連する微生物の検索や新規治療法の開発に取り組んでいます。
・Clostridioides difficileに対する新規ファージ療法の開発
健常者のシークエンスデータおよびこれまで臨床分離株として単離されているC. difficileのシークエンスデータを用いて、C. difficile特異的なプロファージ配列を抽出しました。そのプロファージ配列から、ファージが菌体内で増殖した後に菌体外に放出
健常者のシークエンスデータおよびこれまで臨床分離株として単離されているC. difficileのシークエンスデータを用いて、C. difficile特異的なプロファージ配列を抽出しました。そのプロファージ配列から、ファージが菌体内で増殖した後に菌体外に放出
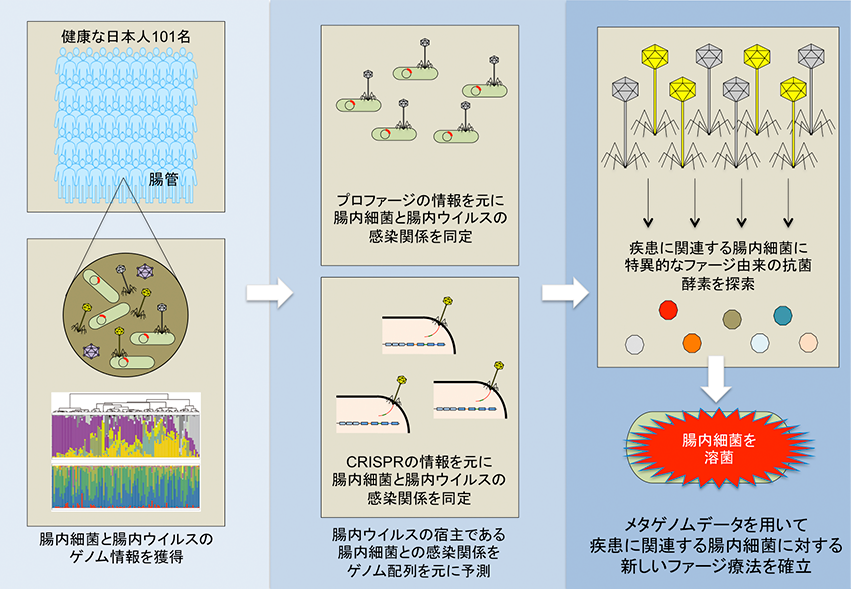
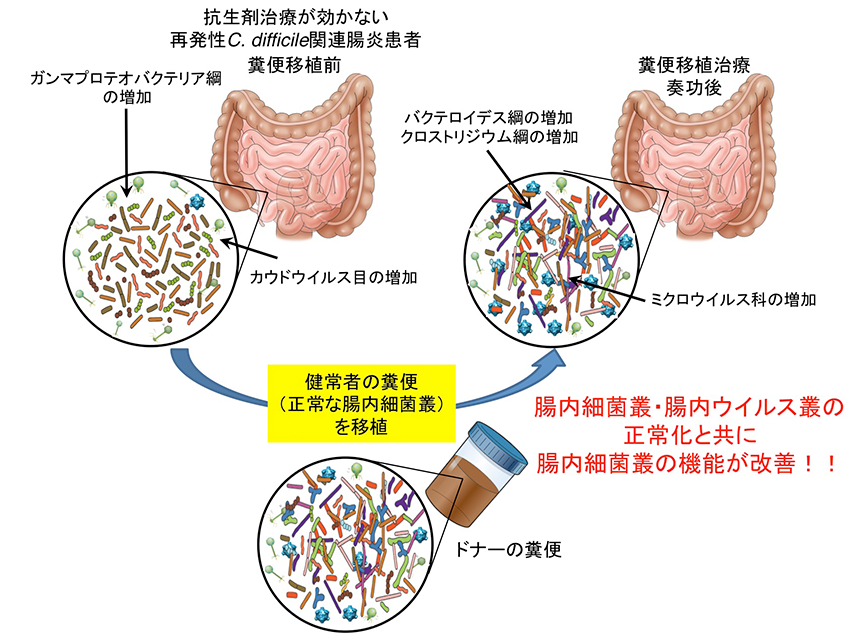
・再発性Clostridioides difficile感染症に対する糞便移植治療前後における腸内微生物叢機能解析
C. difficileは健康な人の腸管にも常在している菌の一つで、普段はおとなしくしています。さまざまな感染症の治療に抗菌薬は有用ですが、広域スペクトルの抗菌薬が使われて正常な腸内細菌叢が破壊されると、C. difficileは増殖し2種類の毒素を出して発熱や下痢を主症状としたC. difficile関連腸炎が起こることがあります。国内では、使用していた抗菌薬を中止し、C. difficileに感受性を持つバンコマイシンやメトロニダゾールといった抗菌薬の投与によって改善を認めることが多いとされています。ところが、欧米ではC. difficileの強毒株の出現や抗菌薬に対する耐性化などにより、治療がうまくいかなかったり、再発したりするケースが多数報告されています。そのような場合には、糞便移植治療が非常に有効だと報告されています。糞便移植治療は、欧米では既に治療ガイドラインに取り入れられている治療法です。しかし、再発性C. difficile 関連腸炎の改善に伴って、腸内細菌やウイルスの構成が変化することは知られているものの、その機能の変化についてはこれまでほとんど明らかとはなっていませんでした。米国ボストンのブリガム・アンド・ウィメンズ病院で糞便移植治療が奏功した再発性C. difficile関連腸炎患者9例およびそのドナーの糞便サンプルから腸内細菌ゲノムと腸内ウイルスゲノムを抽出し、それぞれ全ゲノムシークエンスを行いました。2020年に報告した腸内細菌と腸内ウイルスの解析パイプライン(Fujimoto K, et al.Cell Host & Microbe. 2020.)を用いてその構成割合と感染関係の解析を行いました。糞便移植治療前のサンプルでは抗菌薬の使用に伴った腸内細菌叢の乱れが起こり、ガンマプロテオバクテリア綱の細菌が増加すると共に、カウドウイルス目のウイルスが増加していました。一方、治療後のサンプルでは、バクテロイデス綱・クロストリジウム綱の細菌とミクロウイルス科のウイルスの増加していました。また、治療後の腸内細菌叢およびウイルス叢はドナーの腸内細菌叢およびウイルス叢に近づいていることもわかりました。さらに今回得られたシークエンスデータを用いて、腸内細菌叢の機能解析を行いました。糞便移植治療前では、炎症と関連するフルオロ安息香酸分解経路が特徴的に認められ、移植前で増加し移植後に消失したガンマプロテオバクテリア綱の細菌がこの経路に関わっていることが明らかになりました。移植後では、腸内細菌叢はドナーの構成比に近づいただけでなく、ドナーの腸内細菌叢が持つ機能に近づく(腸内細菌叢の機能が回復している)ことが明らかとなりました。アルギニンおよびオルニチン代謝経路、2次胆汁酸合成経路が糞便移植治療後で特徴的であり、機能の回復によって病態の改善に繋がっていることが分かりました。以上のことから、再発性C. difficile関連腸炎における病態形成に関わる菌群や、腸内細菌叢の機能回復に重要な菌群、遺伝子が明らかになりました(Fujimoto K, et al.Gastroenterology.
C. difficileは健康な人の腸管にも常在している菌の一つで、普段はおとなしくしています。さまざまな感染症の治療に抗菌薬は有用ですが、広域スペクトルの抗菌薬が使われて正常な腸内細菌叢が破壊されると、C. difficileは増殖し2種類の毒素を出して発熱や下痢を主症状としたC. difficile関連腸炎が起こることがあります。国内では、使用していた抗菌薬を中止し、C. difficileに感受性を持つバンコマイシンやメトロニダゾールといった抗菌薬の投与によって改善を認めることが多いとされています。ところが、欧米ではC. difficileの強毒株の出現や抗菌薬に対する耐性化などにより、治療がうまくいかなかったり、再発したりするケースが多数報告されています。そのような場合には、糞便移植治療が非常に有効だと報告されています。糞便移植治療は、欧米では既に治療ガイドラインに取り入れられている治療法です。しかし、再発性C. difficile 関連腸炎の改善に伴って、腸内細菌やウイルスの構成が変化することは知られているものの、その機能の変化についてはこれまでほとんど明らかとはなっていませんでした。米国ボストンのブリガム・アンド・ウィメンズ病院で糞便移植治療が奏功した再発性C. difficile関連腸炎患者9例およびそのドナーの糞便サンプルから腸内細菌ゲノムと腸内ウイルスゲノムを抽出し、それぞれ全ゲノムシークエンスを行いました。2020年に報告した腸内細菌と腸内ウイルスの解析パイプライン(Fujimoto K, et al.Cell Host & Microbe. 2020.)を用いてその構成割合と感染関係の解析を行いました。糞便移植治療前のサンプルでは抗菌薬の使用に伴った腸内細菌叢の乱れが起こり、ガンマプロテオバクテリア綱の細菌が増加すると共に、カウドウイルス目のウイルスが増加していました。一方、治療後のサンプルでは、バクテロイデス綱・クロストリジウム綱の細菌とミクロウイルス科のウイルスの増加していました。また、治療後の腸内細菌叢およびウイルス叢はドナーの腸内細菌叢およびウイルス叢に近づいていることもわかりました。さらに今回得られたシークエンスデータを用いて、腸内細菌叢の機能解析を行いました。糞便移植治療前では、炎症と関連するフルオロ安息香酸分解経路が特徴的に認められ、移植前で増加し移植後に消失したガンマプロテオバクテリア綱の細菌がこの経路に関わっていることが明らかになりました。移植後では、腸内細菌叢はドナーの構成比に近づいただけでなく、ドナーの腸内細菌叢が持つ機能に近づく(腸内細菌叢の機能が回復している)ことが明らかとなりました。アルギニンおよびオルニチン代謝経路、2次胆汁酸合成経路が糞便移植治療後で特徴的であり、機能の回復によって病態の改善に繋がっていることが分かりました。以上のことから、再発性C. difficile関連腸炎における病態形成に関わる菌群や、腸内細菌叢の機能回復に重要な菌群、遺伝子が明らかになりました(Fujimoto K, et al.Gastroenterology.